化学固定法

肝組織の観察
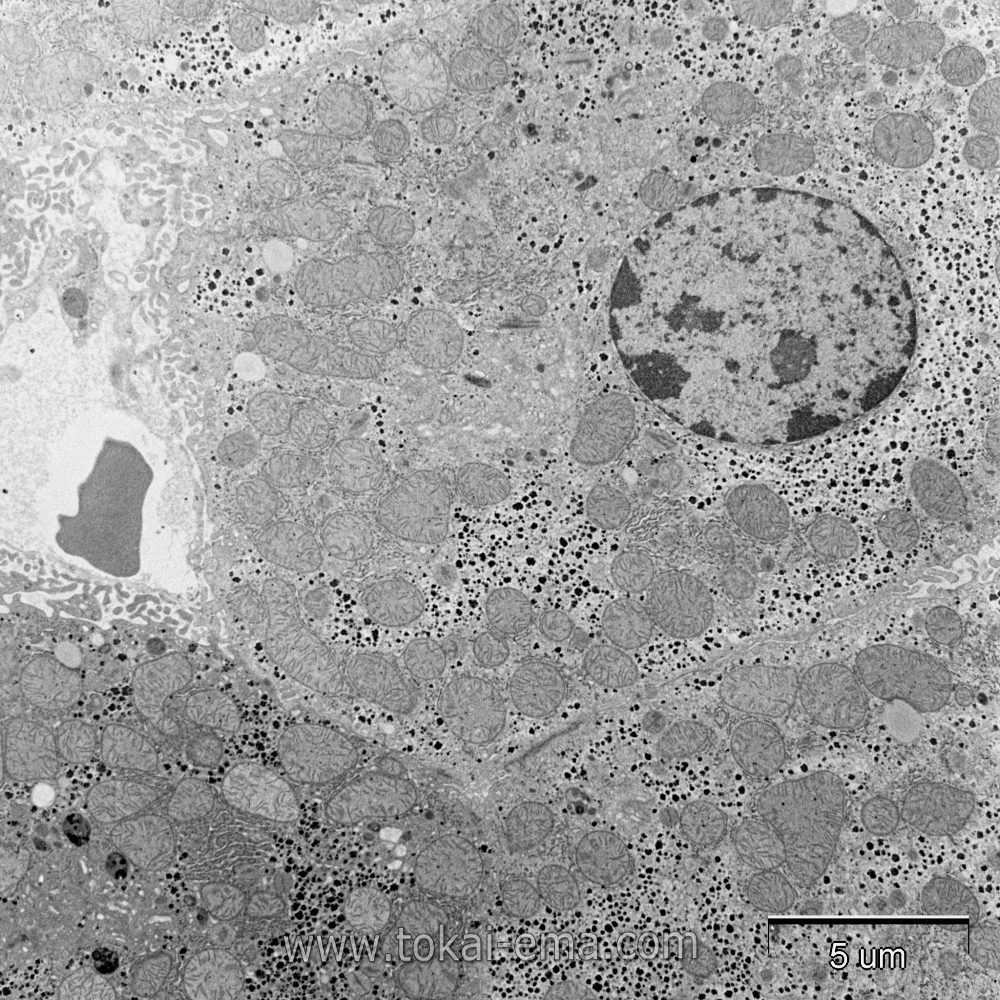
肝細胞は教科書で見るような代表的な細胞小器官が多く観察できます。固定方法は特に難しくはないですが、ここでも注意が必要です。リン酸緩衝液をベースとした固定液を用いますが、ここでもしHEPES緩衝液を用いるとグリコゲン顆粒は不可視の状態になり観察できなくなります。
また、肝細胞は自己融解が早いので摘出後は素早く組織をトリミングし固定液に浸ける必要があります。固定が遅れるとミトコンドリアや核の膜に歪みが生じます。
筋線維細胞の観察
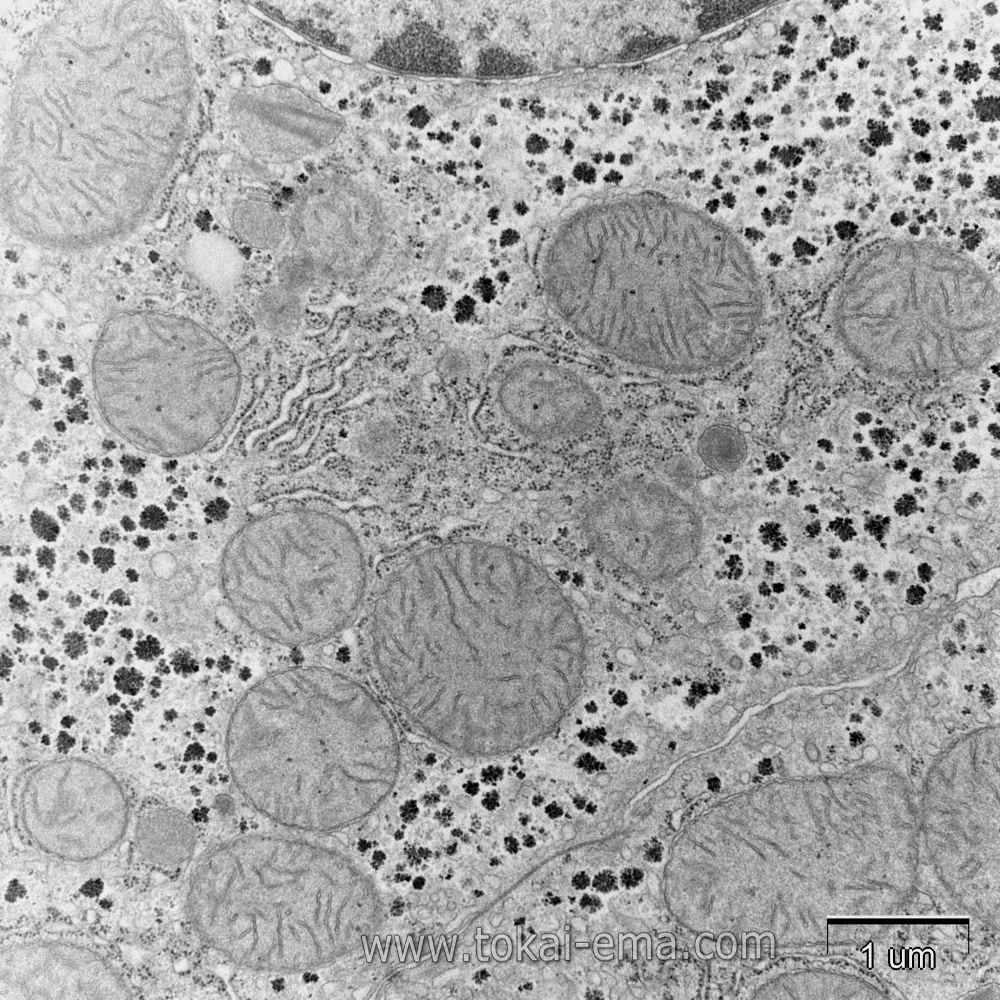
骨格筋などを構成する筋線維細胞は、固定時に著しく収縮してしまいます。その状態で観察しても正確な所見は得られません。細胞の収縮を避けるには灌流固定をおこなうか、それが無理な場合は筋組織の両端を押さえた状態で固定液に浸けることで、収縮を防ぐことができます。
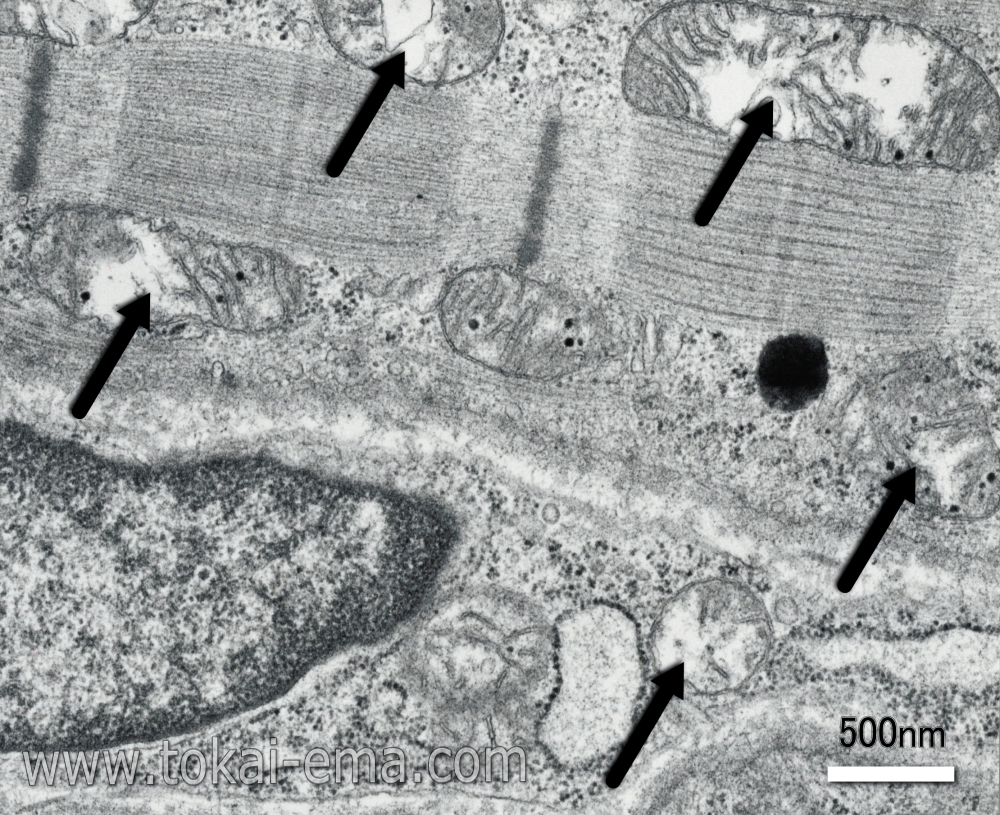
また、筋組織はミトコンドリアの活性が高いため、浸透速度の速い固定液を使用しないと、ミトコンドリアが変形してしまいます(図中矢印)。このミトコンドリアの変形を、所見と読み間違えている事例が散見されます。
植物組織の観察

植物は細胞間隙に空気を含んでいるので、そのままでは固定液中に沈みません。そこで空気を抜く必要があるのですが、その方法はシリンジに入れて減圧する方法や、アスピレータ等で緩やかに減圧する方法があります。
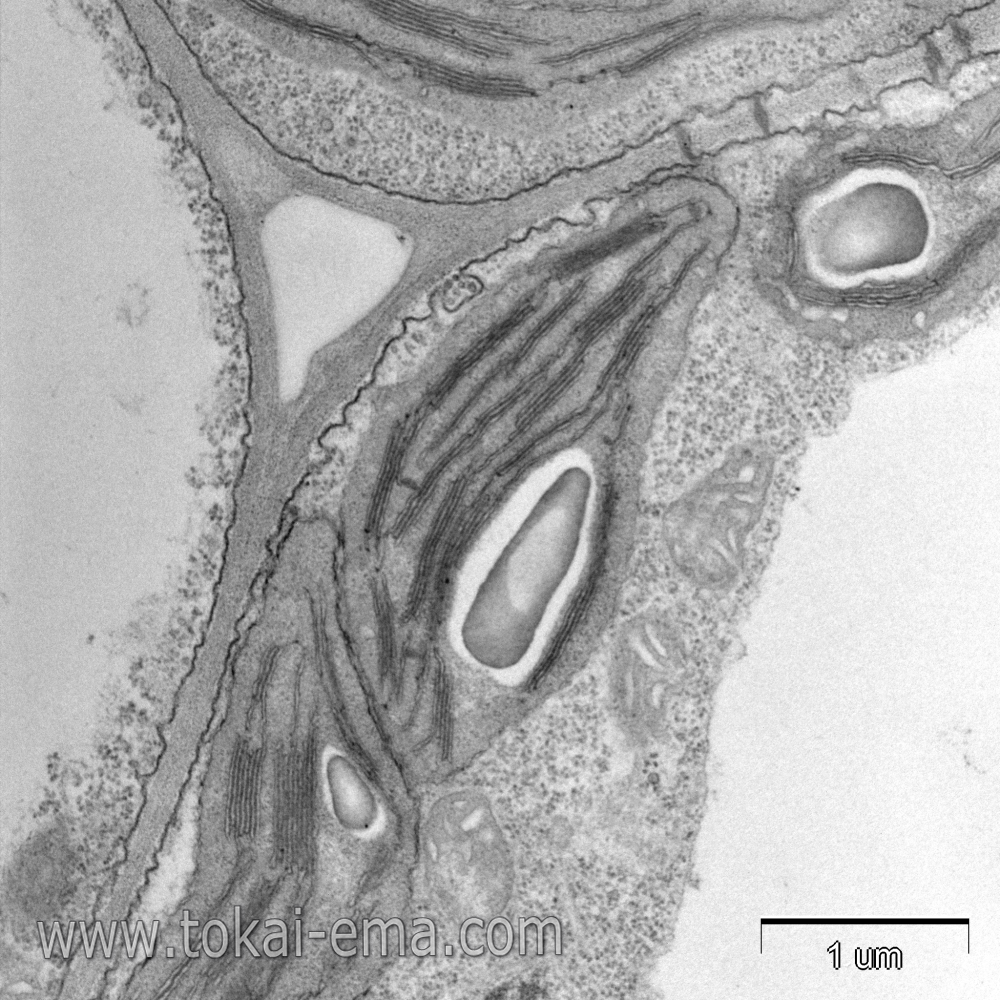
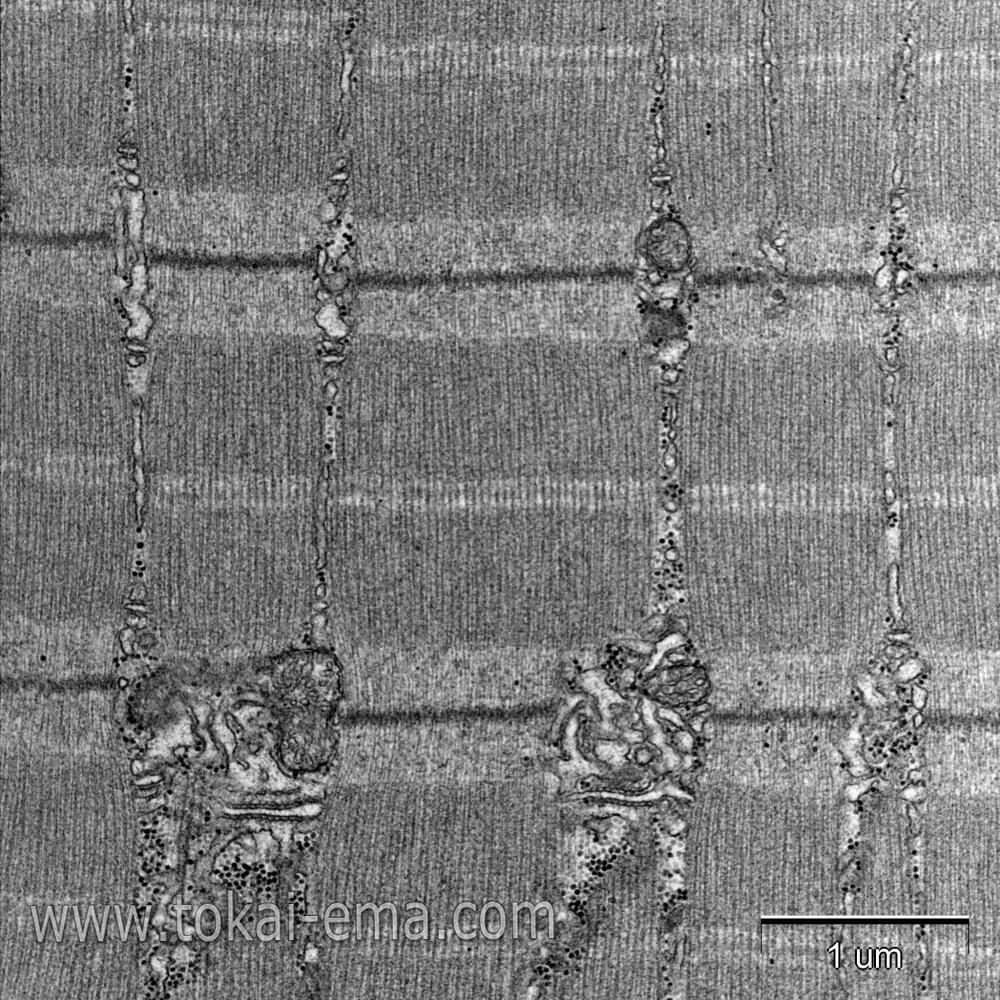
植物細胞は固定時の浸透圧により原形質分離を起こしやすいため、固定液の浸透圧は低めに設定します。さらに、画像をよく見ると分かるように細胞膜が歪む現象が起こりやすいです。これは膜の固定が遅れたために起こる現象です。これを避けるには一次固定から後固定に入るまでの時間を短縮するか、一次固定液と後固定液を混合して固定する方法が有効です。
また、種子や花粉は固定液の浸透性が悪いため、長時間の固定が必要な場合があり、時には一週間以上の時間をかけて試料作製をすることもあります。
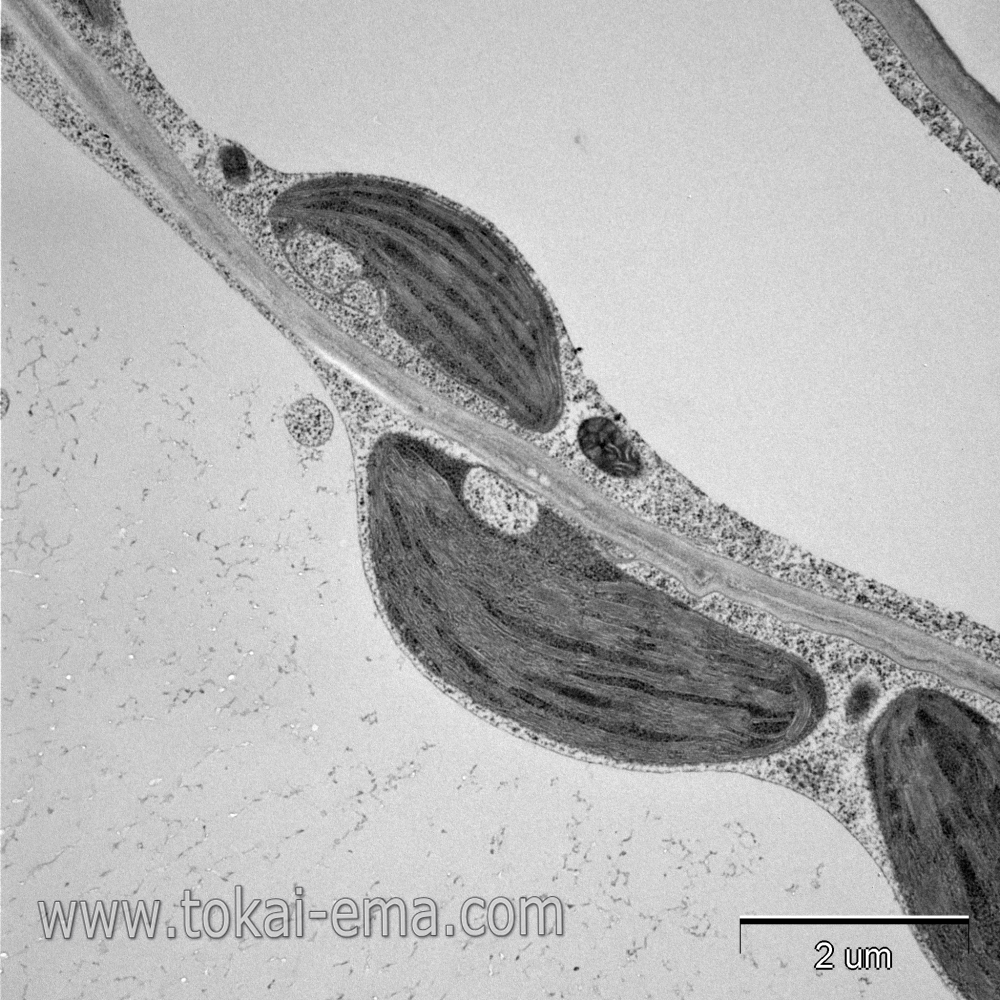
この画像は、急速凍結・凍結置換法で試料作製したものです。固定時のアーティファクトを抑えるには急速凍結・凍結置換法が有効な方法となりますが、植物の場合はその難易度が高いです。この画像では化学固定の像で見られた細胞膜の歪みはありません。
培養細胞の観察(単層)
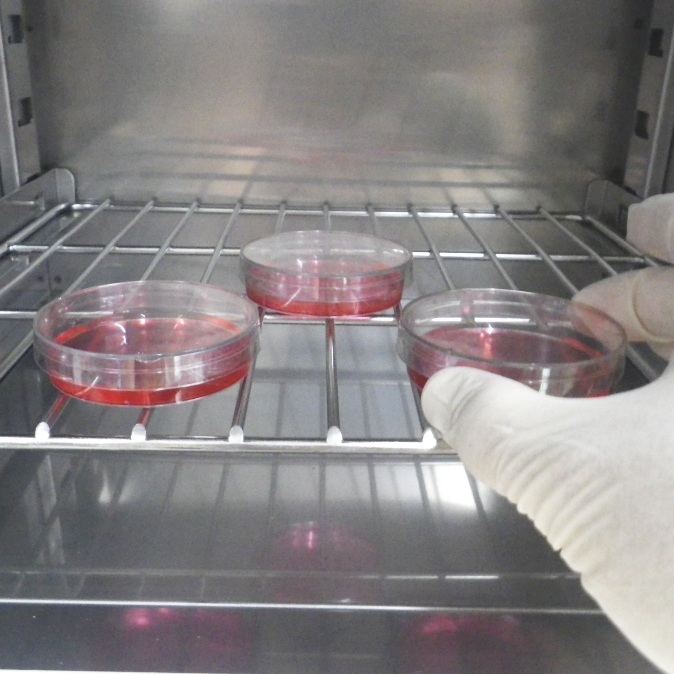
どのような状態で培養しているかで固定の方法が変わります。写真のようなシャーレの底に細胞が貼りついている場合は、シャーレごと固定し、そのまま樹脂包埋まで試料作製を進めます。

切片作製の際にシャーレから樹脂を剥がします。その際に細胞は樹脂側に移りますので、シャーレの底と接していた面から切片作製を始めます。このときに、シャーレの底からどの程度の高さまで切り進めるかが非常に重要になります。さらに比較する試料と正確に高さをそろえる必要があります。単層培養の細胞は急速凍結・凍結置換法でも観察可能です。
培養細胞の観察(液体培地)
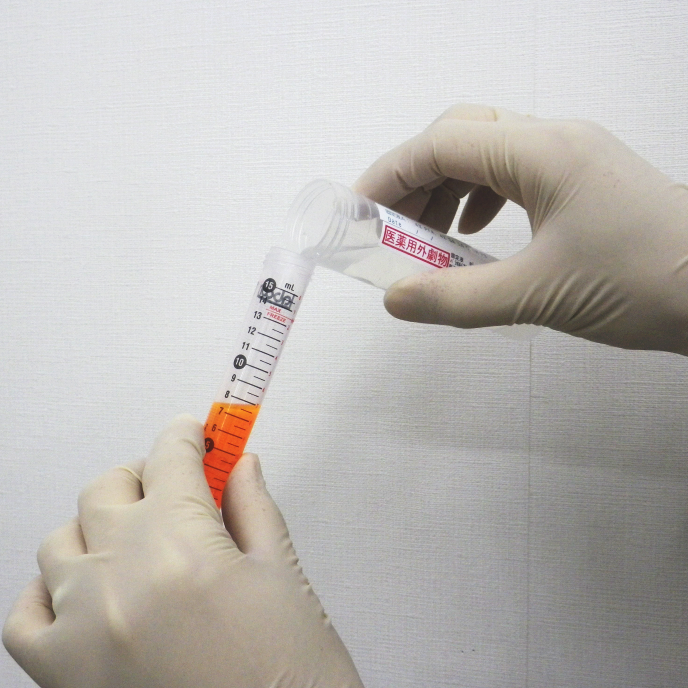
液体培地の場合は、培養液と固定液を等量混合して固定します。そうすることで温度差や浸透圧の急激な変化を和らげることができます。

液体培地の細胞は急速凍結・凍結置換法でも観察可能です。
その他の技法について